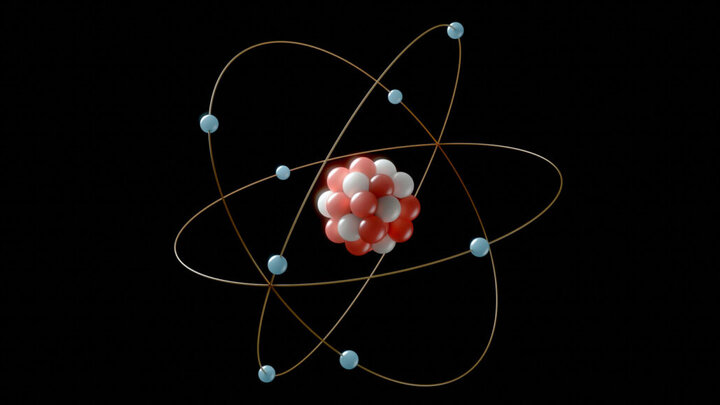
به گزارش خبرنگار ایمنا، آرایش الکترونی نحوه چینش الکترونها را در اوربیتالهای اطراف هسته اتم نشان میدهد که طبق آن در زیر لایه S حداکثر دو، P حداکثر شش، d حداکثر ۱۰ و f حداکثر ۱۴ الکترون جای میگیرد. آرایش الکترونی عناصر از قاعدهای پیروی میکند که تحت عنوان «اصل آفبا» شناخته میشود.
اصل آفبا به معنی بنا کردن است که در شیمی کوانتوم بیانگر روش و نحوه پر شدن لایههای الکترونی در اوربیتالها است؛ براساس این اصل هنگام پر شدن لایههای اوربیتالی ابتدا الکترون در لایههای پایدارتر قرار میگیرد و سپس لایههایی با انرژی بالاتر پر میشود. اصل آفبا برای نخستینبار توسط ولفگانگ پاولی مطرح شد؛ درواقع اساس پر شدن اوربیتالها سطح انرژی آنها است به طوری که الکترونها تمایل دارند ابتدا زیرلایههایی را پر کنند که تراز انرژی کمتری دارد.
به طور کلی قاعده آفبا در علم شیمی از اهمیت بسیاری برخوردار است و با استفاده از آن میتوان به خواص بسیاری پی برد. برای شناخت بیشتر قاعده آفبا و بررسی قواعد و کاربردهای آن با حمیدرضا یوسفی، دکترای شیمی آلی گفتوگویی انجام دادهایم که در ادامه میخوانید:
قاعده آفبا چیست؟
یکی از اصلها و مسائل بسیار مهمی که در تمام دنیا پیرامون علم شیمی مطرح است، مبحث آفبا است؛ این اصل قاعده پرشدن لایههای الکترونی است. هنگامی که پیرامون آرایش الکترونی صحبت میکنیم به مسئلهای تحت عنوان پر شدن لایهها میرسیم که ترتیب آنها وابسته به اصل آفبا است.
قاعده آفبا بر چه اساسی است؟
اصل آفبا بر اساس شیمی کوانتوم تدوین شده است. در شیمی کوانتوم به ریزترین ساختارهای درونی عنصر یعنی الکترون، پروتون و نوترون پرداخته میشود و اصل مهم آفبا نیز بر اساس لایههای الکترونی در اوربیتالها است. در این اصل باید بتوانیم با توجه به عدد اتمی هر عنصر تعداد الکترونها را براساس انرژی و مباحث دیگر در لایههای مختلف قرار دهیم؛ درواقع شناخت لایهها و زیرلایهها در اصل آفبا حائز اهمیت است.
قدمت قاعده آفبا به کجا باز میگردد؟
این قاعده خیلی قدیمی نیست و نزدیک به صد سال پیش مطرح و نامگذاری شده است. قبل از ایجاد شدن قاعده آفبا قرارگیری الکترونها بهصورت پیشبینی بود و اصل طرد پاولی در آن زمان مطرح نشده بود، اما امروزه با اصول و سطح انرژی آشنا شدهایم.
اهمیت شناخت آرایش الکترونی و آشنایی با اصل آفبا چیست؟
از طریق آرایش الکترونی میتوان خواص فیزیکی و شیمیایی، حالتهای مختلف پایداری، سطح انرژی و بسیاری از مطالب مهم عناصر را بهدست آوریم و به همین دلیل شناخت آرایش الکترونی و آشنایی با اصل آفبا حائز اهمیت است.
اصل طرد پائولی و هوند چه ارتباطی با قاعده آفبا دارد؟
هنگامی که میخواهیم الکترون را در لایههای مختلف جایگذاری کنیم، باید این کار را براساس اصول مختلفی انجام دهیم، در این زمینه عدد کوانتومی، مدار و مغناطیس بسیار حائز اهمیت است و نخستین مسئلهای که اصل طرد پائولی به ما یاد میدهد، قراردادن الکترونها براساس قاعدهای بهصورت زوج است.
اصل هوند نیز تکمیلکننده همین مسئله است؛ درواقع بر اساس این اصل باید الکترونها را یکییکی در لایهها قرار داده و سپس اقدام به جفت کردن آنها کنیم؛ البته قاعده آفبا برای تمام عناصر صدق نمیکند و افراد نمیتوانند با استفاده از این اصل تمام عناصر را بررسی کنند.
چرا برخی عناصر از قاعده آفبا مستثنی هستند؟
در قرار دادن الکترونها به تعادل نیاز داریم و به همین دلیل باید از اصل آفبا پیروی کرد، اما برخی از فلزات واسطه مانند مس و کروم برای رسیدن به پایداری از این قاعده پیروی نمیکنند؛ البته استثناهای دیگری نیز در گروه لانتانیدها و آکتانیدها وجود دارد.
کاربرد اصل آفبا چیست؟
کاربرد اصلی قاعده آفبا در قرارگیری الکترونها مشاهده میشود و عملاً کاربردی در زندگی انسان ندارد؛ البته این اصل برای جدول تناوبی مطرح شده و نبود آن چالشهای بسیاری در مسائل مختلف ایجاد میکرد.
اصل آفبا چه تأثیری در جدول تناوبی دارد؟
برای شناخت بهتر تأثیر اصل آفبا در جدول تناوبی باید، عناصر این جدول را به چند قسمت تقسیم کرد؛ درواقع الکترونهای بخش ابتدای جدول تناوبی که از فلزات قلیایی و قلیایی خاکی تشکیل شده است عمدتاً در لایه S تکمیل میشود، اما در بخش پایانی جدول که گازها قرار گرفته است لایه P تکمیل میشود و الکترونهای گروه عناصر واسطه نیز در لایه F قرار میگیرند، همچنین در گروه دو تا ۱۲ نیز لایه D تکمیل میشود.
عملکرد قاعده آفبا چگونه است؟
در قاعده آفبا نخستین عمل مدنظر قراردادن هوند و طرد پائولی است؛ درواقع ابتدا باید بدانیم که طبق اصل طرد پائولی دو الکترون نمیتواند در اتم حالت کوانتومی یکسانی داشتهباشد و به همین دلیل برخی الکترونها به جهت بالا و برخی به جهت پائین ترسیم میشود. طی این اصول لایهها به نحوهای تکمیل میشود که عنصر به حالت تعادل دستیابد؛ در لایه P برخی از عناصر تنها دو الکترون قرار میگیرد که به این حالت نیمهپایدار گفته میشود. به طور کلی قاعده آفبا اصل پر شدن لایهها براساس هوند و پاولی است که تلاش میکند آرامش را به عنصر القا و توازن را رعایت کند.




نظر شما