به گزارش ایمنا و به نقل از (سای تک دیلی)، یک ساختار پروتئینی عجیب و غریب به نام "ورق بتای موج دار" که در ابتدا در سال ۱۹۵۳ فرض شد، اکنون در آزمایشگاه تولید شده و با استفاده از کریستالوگرافی اشعه ایکس به طور کامل مشخص شده است.
یافتههای جدید که در مجله علوم شیمیایی منتشر شده است، ممکن است امکان طراحی منطقی مواد منحصر به فرد را بر اساس معماری ورق موج دار فراهم کند.
Jevgenij Raskatov، دانشیار شیمی و شیمی گفت: "مطالعه ما پیکربندی لایه بتای موج دار را به عنوان یک موتیف با ویژگیهای کلی ایجاد میکند و راه را برای طراحی مبتنی بر ساختار معماریهای مولکولی منحصر به فرد، با پتانسیل برای توسعه مواد و کاربردهای زیست پزشکی باز میکند.
پروتئینها در طیف گستردهای از اشکال و اندازهها وجود دارند تا نقشهای ساختاری و عملکردی بسیاری را در سلولهای زنده انجام دهند.
بسیاری از ساختارهای پروتئینی دارای نقوش ساختاری مشترک همچون مارپیچ آلفا است.
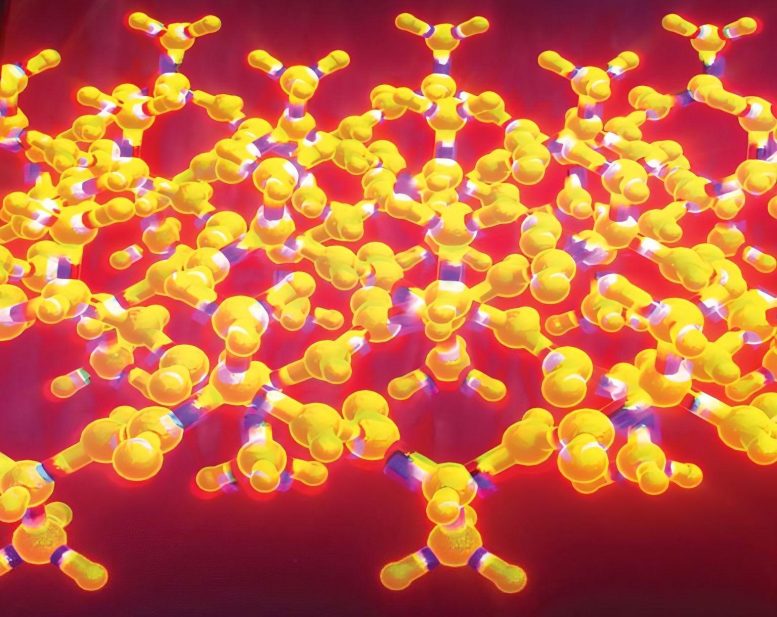
ورق موج دار گونهای از ورقه بتای پلیسه دار است، یک موتیف ساختاری شناخته شده که در هزاران پروتئین وجود دارد. لینوس پاولینگ و رابرت کوری دو سال پس از معرفی مفهوم ورق بتای پلیسه دار، ورق بتای موج دار را توصیف کردند.
در حالی که ورق بتای پلیسه دار عموماً شناخته شده است و معمولاً به آن ورق بتا گفته میشود، ورق موج دار برای دههها نظری باقی مانده است.
در مطالعه قبلی که در سال ۲۰۲۱ منتشر شد، تیم راسکاتوف گزارش داد که با مخلوط کردن یک پپتید کوچک با مقادیر مساوی از تصویر آینهای آن، ساختار بتای موجدار را به دست آوردند. محققان از اشکال آینهای تری فنیل آلانین، یک پپتید کوتاه متشکل از سه اسید آمینه فنیل آلانین استفاده کردند.
پپتیدهای تصویر آینهای به صورت جفت به هم پیوستند تا "دایمر" با ساختار پیش بینی شده را تشکیل دهند، اما توپوگرافی لایه بتا ورق موجدار متناوب که توسط پاولینگ و کوری فرض شده بود را تشکیل ندادند.
راسکاتوف گفت: دایمرها در ساختارهای لایههای شاه ماهی جمع شدهاند، که این تردید را در مورد اینکه آیا پیکربندی لایه بتا ورق موجدار دورهای قابل دوام است ایجاد کرد.
در مطالعه جدید، محققان اسیدهای آمینه دیگری را جایگزین یکی از تری فنیل آلانینها کردند تا تری پپتیدهای کمی متفاوت و تصاویر آینهای آنها ایجاد کنند. با استفاده از این سه پپتیدهای جدید، آنها توانستند سه سیستم پپتیدی تجمعی مختلف ایجاد کنند که لایههای بتای موجدار ضد موازی گستردهای را تشکیل میدادند که در آن رشتههای پپتید تصویر آینهای به شکل متناوب مرتب شده بودند.
نتایج کریستالوگرافی اشعه ایکس نشان داد که ساختارهای بلوری با پیشبینیهای پاولینگ و کوری مطابقت کلی دارند.
منبع: آنا





نظر شما