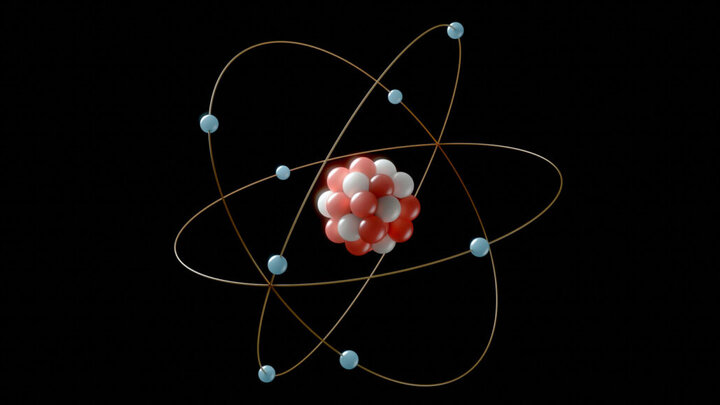
به گزارش خبرنگار ایمنا، آرایش الکترونی نحوه چینش الکترونها را در اوربیتالهای اطراف هسته اتم نشان میدهد که طبق آن در زیر لایه S حداکثر دو، P حداکثر شش، d حداکثر ۱۰ و f حداکثر ۱۴ الکترون جای میگیرد. آرایش الکترونی عناصر از قاعدهای پیروی میکند که تحت عنوان «اصل آفبا» شناخته میشود؛ این قاعده مشخص میکند که ترتیب عناصر پرشده لایه الکترونی باید بهصورت ۲،۸،۸،۲ باشد.
به طور کلی آرایش الکترونی عناصر از اهمیت بسیار بالایی برخوردار است، زیرا بهواسطه این آرایش میتوان بسیاری از ویژگیها و خواص عناصر را مشخص و شناخت بیشتری نسبت به آنها کسب کرد. آرایش الکترونی همچنین گروه و دوره عناصر را نیز مشخص میکند و در پیشبینی رفتار عناصر کاربرد دارد.
برای شناخت بیشتر آرایش الکترونی و بررسی بیشتر کاربردهای این مبحث با حمیدرضا یوسفی، دکترای شیمی آلی گفتوگویی انجام دادهایم که در ادامه میخوانید:
آرایش الکترونی چیست؟
در بررسی جدول تناوبی، اصلی را باید در نظر گرفت که تحت عنوان آرایش الکترونی شناخته میشود؛ درواقع هنگامی که میخواهیم عناصر را مورد بررسی قرار دهیم و به مقیاسهای کوچکتری سفر کنیم با هسته اتم روبهرو میشویم.
لایههای الکترونی چه اهمیتی دارد؟
در عناصر اتمهایی وجود دارد که تمام آنها دارای هسته است و درون این هستهها الکترون، نوترون و پروتون وجود دارد. الکترون در بررسی عناصر بسیار اهمیت دارد و عملاً مهمترین لایهای که میتواند ارتباطات مفیدی مانند پیوند، یون و مولکول تشکیل دهد همین لایه الکترونها است و مقدار تمایل و واکنشپذیری عناصر در این لایه نهفته است.
الکترونها چگونه در لایههای الکترونی جای میگیرد؟
الکترونها طبق یک قانون بسیار مهمی در لایههای الکترونی قرار میگیرد و از قاعدههای مهمی پیروی میکند. برای قرار گرفتن الکترونها زیرلایههایی مانند S، P، D و F که این زیرلایهها طبق اصل بسیار مهم «آفبا» دستهبندی میشود.
قاعده «آفبا» چیست؟
قرارگیری الکترونها در زیرلایههای طبق قاعده «آفبا» انجام میشود و عملاً این قانون نحوه پر شدن لایهها را در نظر میگیرد. تمام عناصر از هیدروژن تا «اوگانسون» که بیشترین الکترون را در لایههای خود جای داده است از قاعده «آفبا» پیروی میکند؛ این مسئله نشان میدهد که برای شناخت بیشتر عناصر باید نگرش جامعه نسبت به اتمها تغییر یابد و افراد برای بررسی الکترونها و مبحث اوربیتال باید وارد دنیای اتمها شوند.
به طور کلی قاعده «آفبا» یک قانون قراردادی است که طبق آن زیرلایهای مانند S دو الکترون و P شش الکترون در خود جای میدهد؛ این مسئله یک قاعده از پیش ثبتشده است که تاکنون تغییری در آن ایجاد نشده است.
آیا تمام عناصر از قاعده «آفبا» پیروی میکند؟
خیر؛ برخی از عناصر جدول تناوبی از قاعده «آفبا» مستثنی است که دانشآموزان در دوران دبیرستان با این عناصر آشنا میشوند. عنصر کروم و مس ازجمله عناصری است که از قاعده «آفبا» پیروی نمیکند و نحوه قرارگیری الکترونها در لایه آخر این عناصر با دیگر موارد متفاوت است.
آرایش الکترونی چگونه بیان میشود؟
آرایش الکترونی به دو صورت بیان میشود. نخستین نحوه نگارش آرایش الکترونی با استفاده از گاز نجیب است که در این روش باید نزدیکترین گاز نجیب به عنصر مورد نظر را پیدا کرده و با استفاده از آن آرایش الکترونی عنصر را رسم کنیم. روش دیگری که برایش نگارش آرایش الکترونی وجود دارد در نظر گرفتن تمام زیرلایهها است که در این روش باید به اصل «آفبا» و نحوه پر شدن لایهها تسلط کافی داشتهباشیم.
اهمیت آرایش الکترونی چیست؟
آرایش الکترونی اطلاعات بسیاری پیرامون عنصر مورد نظر به محققان میدهد؛ از طریق آرایش الکترونی عناصر میتوان جایگاه عنصر مورد نظر را در جدول تناوبی پیدا کرد و با استفاده از مباحث اوربیتال، عدد اتمی و آرایش الکترونی رفتار آنها را پیشبینی کرد.
اگر به دنیای اتمها سفر کنید الکترونها اطلاعات بسیاری از عناصر به شما میدهد؛ با بررسی عناصر متوجه میشویم که در گروه آخر جدول تناوبی، یعنی گازهای نجیب فارغ از عنصر هلیوم که تنها دو الکترون دارد، دیگر عناصر این گروه به nS2 و nP6 ختم میشود که این مسئله نشاندهنده قاعده کلی عناصر گروه آخر جدول تناوبی است.
چنین قاعدههایی در گروههای دیگر جدول تناوبی با اشکال مختلفی وجود دارد و همین قاعده میتواند مسیری برای شناخت بیشتر عناصر محسوب شود؛ درواقع از طریق این قاعده میتوانیم تشخیص دهیم که برای واکنشها از چه عنصری استفاده کنیم.
آرایش الکترونی چه چیزی را مشخص میکند؟
هنگامی که پیرامون یک عنصر بحث میشود، باید بدانیم اگر به 1S1 اشاره شد، یعنی پیرامون شماره لایه، عدد کوانتومی و تعداد الکترونهای ظرفیت و شکل اوربیتال عنصر صحبت شده است؛ درواقع آرایش الکترونی این مسائل را مشخص میکند و به واسطه همین مباحث میتوان به ویژگیهای مختلف و اطلاعات اصلی عناصر دست پیدا کرد.
چه دانشمندانی پیرامون گسترش آرایش الکترونی فعالیت کردند؟
دانشمندان بسیاری پیرامون مبحث آرایش الکترونی و گسترش آن فعالیت کردند که از جمله آنها میتوان به «مندلیف» و «شرودینگر» اشاره کرد. دستاورد این افراد باعث شد مباحثی مانند کوانتوم و انرژی شکل بگیرد و عملاً بهوجود آمدن مبحث آرایش الکترونی باعث شد، جامعه دید بهتری نسبت به اتم پیدا کند.



نظر شما